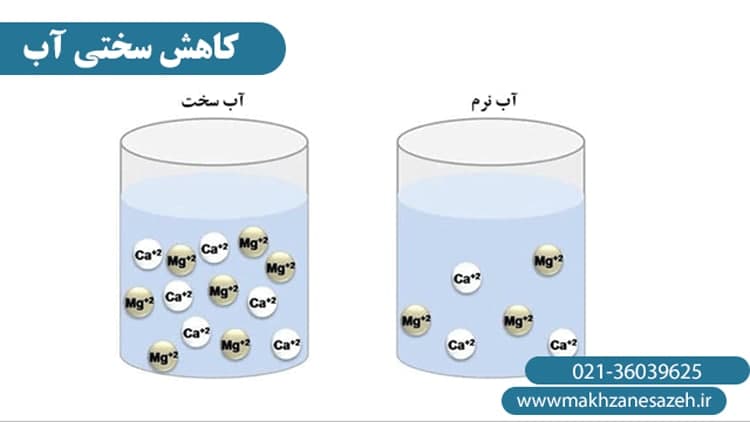
املاح و عناصر موجود در آب ، با توجه به میزان و نوع املاح ،درجه سختی آب را تعیین کرده و متفاوت می باشند. سختی گیری آب شامل حذف کلسیم، منیزیم و بعضی دیگر از کاتیون های فلزی موجود در آب سخت می باشد.از همین رو انتخاب نوع رزین سختی گیر نیز برای شرایط متفاوت، قاعدتا متفاوت خواهد بود.باید بدانیم که در صد سختی آب در مناطق مختلف و با توجه به منطقه جغرافیایی متغییر است.سختی آب وقتی وجود می آید که آب سرشار از مواد معدنی شامل کلسیم و منیزیوم باشد.باید توجه داشته باشد که مود معدنی دیگری مانند آهن،منگنز، آلومینیوم و روی نیز در آب سخت وجود دارند.هرچقد که میزان کلسیم و منیزیم بیشتر باشد،میزان درصد سختی آب بالاتر خواهد بود.
به طور کلی می توان سختی آب را به دو دسته تقسیم کرد، دسته اول سختی موقت ،دسته دوم سختی دائم.در سختی موقت،در اثر حرارات دادن به آب املاح بی کربنات کلسیم و منیزیم از حالت محلول خارج شده و به صورت غیر محلول در می آید ولی در سختی دائمی با حرارت دادن به آب املاح موجود در آب از حالت محلول خارج نمی شود. می دانیم که مصرف آب سخت مشکلات زیادی برای صنعت و زندگی ایجاد می کند.در نظر گرفتن روشهایی برای کاهش سختی آن ضرورت پیدا می کند. برای نمونه در صنعت موجب آسیب زدگی و خوردگی خطوط لوله و ایجاد لایه آهکی روی جداره دیگ های بخار و تاسیسات وابسته می شود.همچنین در مصرف شرب احتمال تشکیل مجدد سنگ در افراد میتلا به سنگ کلیه را افزایش می دهد.
سختی آب چه مشکلاتی ایجاد می کند؟
مهم ترین مشکلاتی که آب سخت به وجود میآورد عبارت است از :
- هدر رفتن صابون و مواد کف زا
- لک دار شدن ظروف شیشه ای
- آسیب زدگی وخوردگی خطوط لوله
- ایجاد رسوب در جداره درونی دیگ های بخار و لوله ها
- رسوب کردن در پارجه و لباس بر اثر شستشوی مداوم
- احتمال تشکیل مجدد سنگ در افراد مبتلا به سنگ کلیه
- و …

روش های برای کاهش سختی آب
کاهش سختی آب معمولا از طریق سختی گیری با آهک یا سختی گیر رزینی انجام می گیرد.رایج ترین روش ها برای از بین بردن و ککاهش آب متکی به رزین های تبادل یونی یا اسمز معکوس می باشد.سایر رویکرد ها که شامل روش های ته نشینی،تجربه و جداسازی می باشند. با اضافه نمودن عوامل چنگاله (در عم شیمی و مهندسی بسپارفبه ترکیبی ناجور حلقه که دارای حدقل یک کاتیون فلزی (درهم تافت ها) یا یون هیدروژن است،چنگاله یا کی لیت می گویند) صورت می گیرد.
- استفاده از آهک
آهک را به طور معمول به صورت آب آهک یا شیر آهک به کار میبرند،این ماده نخست با گاز CO2آزاد در آب واکنش می دهد و به کربنات هیدروژن کلسیم (بی کربنات کلسیم ) تبدیل می شود که درآب انحلال پذیر است و خود سبب افزایش یافتن میزان سختی آب می شوند.
- استفاده از کربنات سدیم
در مواردی که پس از حذف سختی کربناتی، آب هنوز دارای سختی غیر کربناتی باشد،می توان از کربنات سدیم NA2CO3 برای حذف یون های کلسیم و منیزیم موجود در آب استفاده کرد.
- استفاده از هیدروکسید سدیم
از هیدروکسید می توان به جای آهک یا کربنات سدیم، استفاده کرد.
- استفاده از کربنات باریم
در مواردی که سختی آب از نوع غیر کربناتی است و مقدار سولفات های کلسیم ،منیزیم و سدیم آنها زیاد است،می توان از کربنات باریم برای حذف این نمک وتبدیل آن به سولفات باریم و کربنات کلسیم که هردو انحلال ناپذیر هستند،استفاده کرد.
- استفاده از فسفات سدیم
این نمک میتواند نه تنها یون های کلسیم و منیزیم بلکه یون های منگنز و آهن را نیز به فسفات های انحلال پذیر تبدیل کند.
- استفاده از رزین مبادله گر یون ها برای زدودن سختی
پژوهشگران از دیرباز برای جداکردن این گونه یونها ،تلاش کرده اند و راه چاره را در استفاده از رزین ها یافته اند. با استفاده روش های شیمیایی به منظور سختی زدایی، یون های فلزی کلسیم ، منیزیم منگنز ، آهن و … را می توان تا حدی از آب جدا کرد و آب را سبک نمود. اما در این روش نه تنها آنیون های مزاحم موجود در آب حذف نمی شوند، بلکه برمقدار برخی از آنها افزوده می شود.
- انواع رزین های طبیعی مبادله گر یونی
این رزین ها که نام عمومی زئولیت ها معروف اند،نخستین بار توسط دانشمند سوئدی بنام کرونشند مورد بررسی قرار گرفتند و خاصیت مبادله گری یون ها در آنها کشف شد.
کاهش املاح آب به روش ته نشینی اگر چه یک فرآیند قدیمی می باشد،اما هنوز در بسیاری از صنایع مورد استفاده قرار می گیرد. یکی از مهم ترین ویژگی های این روش اقتصادی بودن آن است.در روش ته نشینی هنگامی که حجم آب صنعتی مورد نیاز خیلی زیاد باشد املاح موجود درآب از طریق انجام واکنش شیمیایی به صورت جلب سطحی یا رسوب درآورده می شود.سپس از طریق ته نشینی از آب جدا می شوند.در این فصل کاهش سختی به روش آهک زنی،کاهش آهن و منگنز و همچنین کاهش سیلیکا مورد بررسی قرار می گیرد.

املاح سختی آور آب به دو دسته تقسیم می شوند:
الف)سختی دائم یا سختی غیر کربناتی :منظور املاح سولفات،کلراید،نیترات و…کلسیم و منیزیم می باشند که دراثر حرارت دادن تجزیه نمی شوند.
ب)سختی موقت یا سختی کربناتی:منظور املاح بی کربناتی کلسیم و منیزیم هستند که در اثر حرارت دادن تجزیه شده و تولید رسوب کربنات کلسیم می کنند.
Ca(HCO3)2+H2O—CaCO3–+CO2—+2H2O
توجه:در تصفیه ی آب سختی دائم بر سختی موقت ترجیح داده می شود.
علت:سختی موقت با افزایش دما در زمان و مکانی نامناسب تولید رسوب کربنات کلسیم و گازCO2 می کند که گاز CO2 کنترل PH محیط را دشوار می کند.
محاسبه ی سختی دائم و موقت بر اساس سختی کل و قلیاییت کل
اگرHسختی کل(یعنی مقدار کلسیم و منیزیم برحسب معادل کربناتی) وM قلیائیت کل باشد.آنگاه:
1-اگرH>Mسختی دائم=H-M سختی موقت=M
-2اگرM=Hسختی دائم=صفر سختی موقت=M=H
-3اگرM=Hسختی دائم =صفر سختی موقت=M
کاهش سختی موقت
اگرچه سختی موقت با روش های فیزیکی مثل حرارت دادن قابل حذف می باشد،اما امروزه هم سختی موقت و هم سختی دایم را با روش های شیمیایی می توان حذف کرد.برای حذف شیمیایی سختی موقت آب آهکCa(OH)2 را به آب اضافه می کنند.در این صورت در اثرترکیب آب آهک با املاح بی کربنات موجود در آب تولید کربنات کلسیم و هیدروکسید منیزیم می شود.سپس این ترکیبات نامحلول ته نشین شده و از طریق فیلتراسیون جداسازی می شوند بدین ترتیب میتوان آب زلال و پاکی به دست آورد.
HCO3+OH—CO2+H2O
CO3+Ca2+—–CaCO3
تفسیر روابط فوق:در ابتدا هیدروکسید موجود در آب آهک با بی کربنات موجود در آب تولید یون کربنات میکند.از هیدروکسید منیزیم است بنابراین کربنات منیزیم باآب آهک مجددأ واکنش می دهد و تولید هیدروکسید منیزیم میکند.
Mg2++CO-23—-MgCO3
MgCO3+ca(OH)2—CaCO3+Mg(HO)2
توجه:برای حذف هر مول سختی منیزیمی 2مول آب آهک احتیاج است.یک مول برای تبدیل بهMg(OH)2 و یک مول برای تبدیل بهMgCO3.
کاهش سختی دائم
برای حذف سختی دایم از سودا یا کربنات سدیم (Na2CO) استفاده می شوند.لازم به ذکر است که برای کاهش سختی دائم نمیتوان از آب آهک استفاده کرد؛زیرا نتیجه ی واکنش بی اثر است.
CaCI2+Ca(OH)2—— بی اثر
توجه:سختی کلسیمی با تولید کلسیم کربنات و سختی منیزیم با تولید هیدروکسید منیزیم از بین می رود.پس باید یون هیدروکسید وارد محیط شود.بدین منظور برای حذف سختی منیزیمی غیرکربناتی علاوه بر سودا از یک ماده قلیانی مثل سود (NaOH) یا آب آهک Ca(OH)2 استفاده می شود.
CaSO4+Na2CO3 CaCO3+Na2SO4
MgSO4+Na2CO3+Ca(OH)2 Mg(OH)2+CaCO3+NaSO4
مان طور که مثل بالا می بینیم برای حذف هر مول سختی منیزیمی غیرکربناتی یک مول سودا و یک مول آلآهک نیاز است.
ارزیابی فرآیند آهک سودا زنی
فرآیند های آهک سودا زنی به طور صد درصد کامل نیستند.از این رو پس ازآن مقداری سختی باقی می ماند که می توان آن را هم کاهش داد.به عنوان مثال اگر آک و سودا بیش تر از مقدار استوکیومتری استفاده شوند،به علت اثر یون مشترک،حلالیت کربنات کلسیم و هیدروکسید منیزیم کاهش می یابد.
توجه:
1-آهک تمام سختی کربناته و سختی غیرکربناته منیزیمی را حذف می کند.
